La historia de la tabla periódica no comenzó de la noche a la mañana con Dmitri Mendeleiev. Décadas antes de su célebre tabla de 1869, otros científicos ya habían observado patrones periódicos en los elementos químicos. En especial, dos precursores de Mendeleiev aportaron ideas visionarias: el geólogo francés Alexandre-Émile Béguyer de Chancourtois, creador de la “hélice telúrica” o espiral telúrica, y el químico británico John Alexander Reina Newlands, formulador de la “ley de las octavas”.
Aunque en su época sus propuestas fueron ignoradas o incluso tomadas a broma, hoy se les reconoce como pasos fundamentales en el desarrollo de la tabla periódica moderna. A continuación exploramos sus biografías, sus sistemas clasificatorios pioneros y el impacto que tuvieron en la evolución del sistema periódico.
Alexandre-Émile Béguyer de Chancourtois y la “hélice telúrica”
Alexandre-Émile Béguyer de Chancourtois (París, 20 de enero de 1820 – París, 14 de noviembre de 1886) fue un geólogo y mineralogista francés, considerado el primero en clasificar los elementos químicos según su masa atómica. Estudió en la École Polytechnique (desde 1838) y en la Escuela Superior de Minas de París (desde 1840). Tras expediciones científicas en su juventud, desarrolló su carrera como profesor de topografía minera y luego de geología en la Escuela de Minas de París. También fue Inspector General de Minas en Francia, donde impulsó importantes normas de seguridad minera. Su formación multidisciplinar y el acceso a los datos de masas atómicas (estandarizados en el Congreso de Karlsruhe de 1860) le prepararon para un aporte único a la química.
La “espiral telúrica” de Chancourtois
En 1862, Chancourtois elaboró la primera clasificación periódica de los elementos. Construyó una hélice de papel que dispuso alrededor de un cilindro vertical, marcando una vuelta cada 16 unidades de masa atómica (tomando el peso atómico del oxígeno = 16 como referencia). Sobre esta hélice (a la que llamó en francés vis tellurique, “hélice” o espiral telúrica porque el elemento Telurio quedaba aproximadamente en el centro), colocó los elementos conocidos en orden creciente de peso atómico. El resultado fue que elementos con propiedades similares quedaban alineados verticalmente en la generatriz del cilindro, mostrando una clara periodicidad. Chancourtois incluso afirmó que “las propiedades de los elementos son propiedades de los números”, reflejando que las características químicas dependen de patrones numéricos (sus pesos atómicos). En la imagen a continuación se ilustra el concepto de la hélice o tornillo telúrico ideado por Chancourtois, donde cada vuelta completa del cilindro abarca 16 unidades de masa atómica y alinea elementos afines verticalmente:
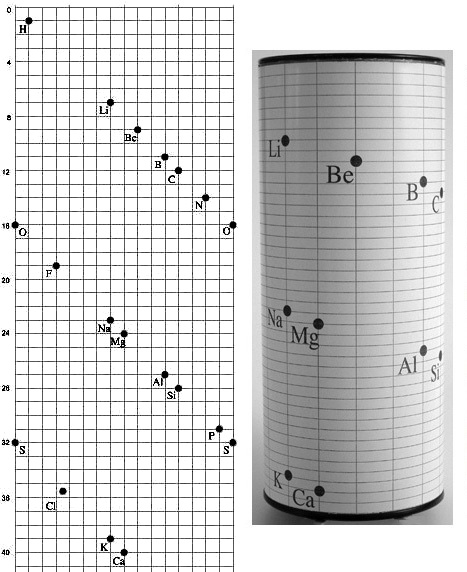
Recepción y legado
La propuesta de Chancourtois, publicada en 1862 en Comptes Rendus de la Academia de Ciencias de Francia, no tuvo el impacto esperado. Por un lado, la revista omitió el diagrama original de la hélice al imprimir su artículo, dificultando la comprensión de sus hallazgos. Además, Chancourtois escribió sus conclusiones en terminología geológica, lo que hizo que los químicos de la época no le prestaran atención e incluso rechazaran su trabajo por considerarlo ajeno a la química. En consecuencia, su descubrimiento de la periodicidad pasó prácticamente inadvertido. No fue sino hasta 1869, con la tabla periódica de Mendeleiev, que la idea de una repetición periódica en las propiedades de los elementos ganó reconocimiento general. Chancourtois, que había creado una tabla periódica temprana, quedó en la sombra durante años. Sin embargo, posteriormente su aporte fue reivindicado: hoy se le reconoce como el primer científico en vislumbrar la periodicidad química al ordenar los elementos por peso atómico. Su espiral telúrica se considera un precursor directo de las posteriores tablas periódicas bidimensionales, y el modelo original de su “tornillo telúrico” se exhibe actualmente en el museo de la Escuela de Minas de París, recordándonos que él sentó uno de los cimientos de la química periódica.
John Alexander Reina Newlands y la ley de las octavas
John A. R. Newlands (Londres, 26 de noviembre de 1837 – Lower Clapton, Middlesex, 21 de julio de 1898) fue un químico analítico inglés que en 1863 preparó una tabla de los elementos ordenada por masas atómicas y enunció la ley de las octavas, observando que cada ocho elementos se repetían propiedades similares. Newlands provenía de una familia humilde (padre escocés presbiteriano, madre italiana) y desde joven mostró vocación científica y social. Estudió química en el Royal College of Chemistry de Londres, pero también participó en movimientos de reforma social; en 1860 se alistó como voluntario en la campaña militar de Giuseppe Garibaldi por la unificación italiana. De regreso en Inglaterra, ejerció como químico analítico a partir de 1864 y llegó a ser jefe de química en una refinería de azúcar en 1868, donde introdujo mejoras técnicas. Más adelante trabajó junto a su hermano en un laboratorio privado. Esta trayectoria le dio experiencia práctica y conocimiento de los elementos conocidos en su época (unos 62 elementos), lo que lo llevó a buscar patrones en sus propiedades.
La “ley de las octavas” y la tabla periódica de Newlands: Inspirado por trabajos previos (como las triadas de Döbereiner) y utilizando los pesos atómicos aceptados tras Cannizzaro, Newlands ordenó los elementos por peso atómico creciente y pronto notó algo sorprendente: cada siete elementos, el octavo tenía propiedades semejantes al primero de la serie anterior. En otras palabras, los elementos parecían repetir comportamientos químicos cada intervalo de siete, algo análogo a la escala musical donde la octava nota repite la tonalidad de la primera. En 1865 anunció formalmente esta regularidad, a la que bautizó como ley de las octavas justamente por la analogía musical. Para ilustrar su ley, Newlands propuso en 1864-1866 una tabla periódica temprana: agrupó los ~62 elementos conocidos en 8 columnas (octavas), con 7 elementos en cada columna, de modo que en cada fila horizontal (período) los elementos tenían propiedades crecientes y el octavo elemento caía debajo de uno con propiedades similares. En su primera versión dejó espacios vacíos anticipando elementos aún por descubrir, aunque en la versión de 1866 optó por no dejar huecos e incluso llegó a colocar dos elementos en la misma posición cuando las cuentas no cuadraban. A pesar de estas limitaciones, la tabla de Newlands fue la primera en Inglaterra en mostrar una periodicidad química clara. En la siguiente imagen se aprecia la tabla de las octavas según Newlands (versión de 1865-66), donde los elementos están organizados en series de 7 y se repiten cada 8º con propiedades semejantes:
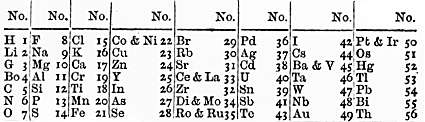
Tabla periódica propuesta por John A. R. Newlands (1865-1866), organizada según la ley de las octavas. Los elementos (indicados con sus símbolos químicos y pesos atómicos) se disponen en columnas de 7; el elemento inmediatamente después de cada serie de siete presenta propiedades análogas al primero de la serie previa, repitiendo patrones periódicos cada ocho posiciones
Recepción y reconocimiento tardío
La innovación de Newlands no fue bien recibida inicialmente. Cuando presentó sus hallazgos, muchos colegas ridiculizaron la “ley de las octavas” por considerarla una coincidencia más que un principio científico. En una reunión de la Sociedad Química de Londres en 1866, se llegó a preguntar irónicamente si no sería igual de válido ordenar los elementos alfabéticamente, insinuando que la idea de las octavas era arbitraria. La Royal Society ni siquiera quiso publicar su trabajo teórico por temor a que les restara prestigio. Newlands quedó profundamente decepcionado al ver su esquema tratado “a broma” por sus contemporáneos. Sin embargo, con el tiempo su acierto sería vindicado. Tras la consagración de la tabla periódica de Mendeleiev (y del alemán Lothar Meyer) en 1869, quedó claro que Newlands había dado un paso clave. En 1882, Mendeleiev y Meyer recibieron la prestigiosa Medalla Davy de la Royal Society por descubrir la ley periódica; Newlands reclamó con razón su parte del mérito, dado que él la había anticipado. Finalmente, en 1887 la Royal Society otorgó la Medalla Davy a Newlands como reconocimiento tardío a su contribución pionera. Hoy Newlands es recordado como precursor de la tabla periódica, y la “ley de las octavas” se enseña como un intento temprano –aunque imperfecto– de dar orden al reino de los elementos químicos, abriendo el camino para Mendeleiev.
Contribución al desarrollo de la tabla periódica moderna
Tanto Chancourtois como Newlands sentaron bases importantes para la tabla periódica actual. Sus trabajos demostraron, antes de 1870, que los elementos exhiben periodicidad en sus propiedades al ordenarlos por peso (o masa) atómico. Si bien sus sistemas presentaban limitaciones (Chancourtois usó un formato tridimensional complejo; Newlands no pudo explicar excepciones más allá del calcio), ambos anticiparon la idea central de que las propiedades químicas se repiten con cierta regularidad. Dmitri Mendeleiev pudo construir en 1869 una tabla periódica más completa en buena medida porque se apoyó en el concepto de periodicidad que estos precursores ya vislumbraron. De hecho, Mendeleiev reconoció públicamente el trabajo de algunos de sus predecesores al perfeccionar su tabla (aunque es debatido cuánto conocía del trabajo de Newlands en su momento). En perspectiva histórica, Chancourtois y Newlands son considerados pilares en la historia de la tabla periódica, verdaderos precursores de Mendeleiev. Sus propuestas, inicialmente ignoradas o menospreciadas, cobraron valor con el tiempo: hoy sabemos que la hélice telúrica de Chancourtois fue la primera representación periódica de los elementos , y la ley de las octavas de Newlands, la primera formulación explícita de una periodicidad química. Ambos contribuyeron a que la ciencia química estuviera preparada para el gran salto que supuso la tabla de Mendeleiev. Su legado perdura en cada versión moderna de la tabla periódica, recordándonos que el avance científico es un esfuerzo colectivo y acumulativo a través de la historia.
Referencias
Béguyer de Chancourtois, A.-É. (1862). Vis tellurique, représentant la loi naturelle des corps simples. Comptes rendus hebdomadaires des séances de l’Académie des Sciences, 54, 757–761.
Brock, W. H. (1992). The Fontana History of Chemistry. London: Fontana Press.
Gordin, M. D. (2004). A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York: Basic Books.
Jensen, W. B. (2002). The periodic law and the law of octaves. Foundations of Chemistry, 4(2), 117–128. https://doi.org/10.1023/A:1015791615140
Newlands, J. A. R. (1865). On the law of octaves. Chemical News, 12, 83–85.
Scerri, E. R. (2007). The Periodic Table: Its Story and Its Significance. Oxford: Oxford University Press.
Van Spronsen, J. W. (1969). The Periodic System of Chemical Elements: A History of the First Hundred Years. Amsterdam: Elsevier.
Weeks, M. E., & Leicester, H. M. (1968). Discovery of the Elements (7th ed.). Easton, PA: Journal of Chemical Education.

